成天软件海量科研管理资讯平台提供:
7月5日,中科中山药物创新研究院研究员段佳课题组、李翼课题组联合中国科学院上海药物研究所研究员徐华强课题组、杨德华课题组,报道了非甾体抗炎药物氟芬那酸改造化合物Compound 28.1(Cpd 28.1)结合苦味受体TAS2R14分别偶联Ggust和Gi复合物结构,揭示了苦味受体独特的双口袋配体识别和G蛋白偶联机制。相关研究发表于《细胞研究》。
人类主要有酸、甜、苦、鲜和咸5种基本味觉,其中苦味、甜味和鲜味均由GPCR介导。人体中苦味受体总共有25个成员,主要在味蕾中的味觉受体细胞中表达,在脑、肠道、生殖系统、胰腺等口腔外周组织中的表达丰度也非常高。系统阐明苦味受体的配体识别、受体激活以及G蛋白偶联机制,对于理解人体苦味感知以及基于苦味受体的理性药物设计具有重大意义。
研究团队发现,Cpd 28.1激活TAS2R14不仅能够招募味觉受体特异的G蛋白Ggust,还具有显著的Gi2招募活性,提示苦味受体TAS2R14可能在口腔外周组织通过偶联Gi发挥G蛋白信号依赖的生理功能。TAS2R14存在1个独特的胞内口袋,研究团队首次证实,该正构口袋中是胆固醇分子与Cpd 28.1的混合物。研究人员认为,在TAS2R14-Ggust复合物中,正构口袋更倾向结合配体Cpd 28.1,而在TAS2R14-Gi复合物中,正构口袋更倾向于结合胆固醇分子。此外,受体的正构口袋和胞内口袋之间的芳香氨基酸残基簇形成的疏水网络与受体激活密切相关,且Ggust和Gi与受体的偶联模式相似。
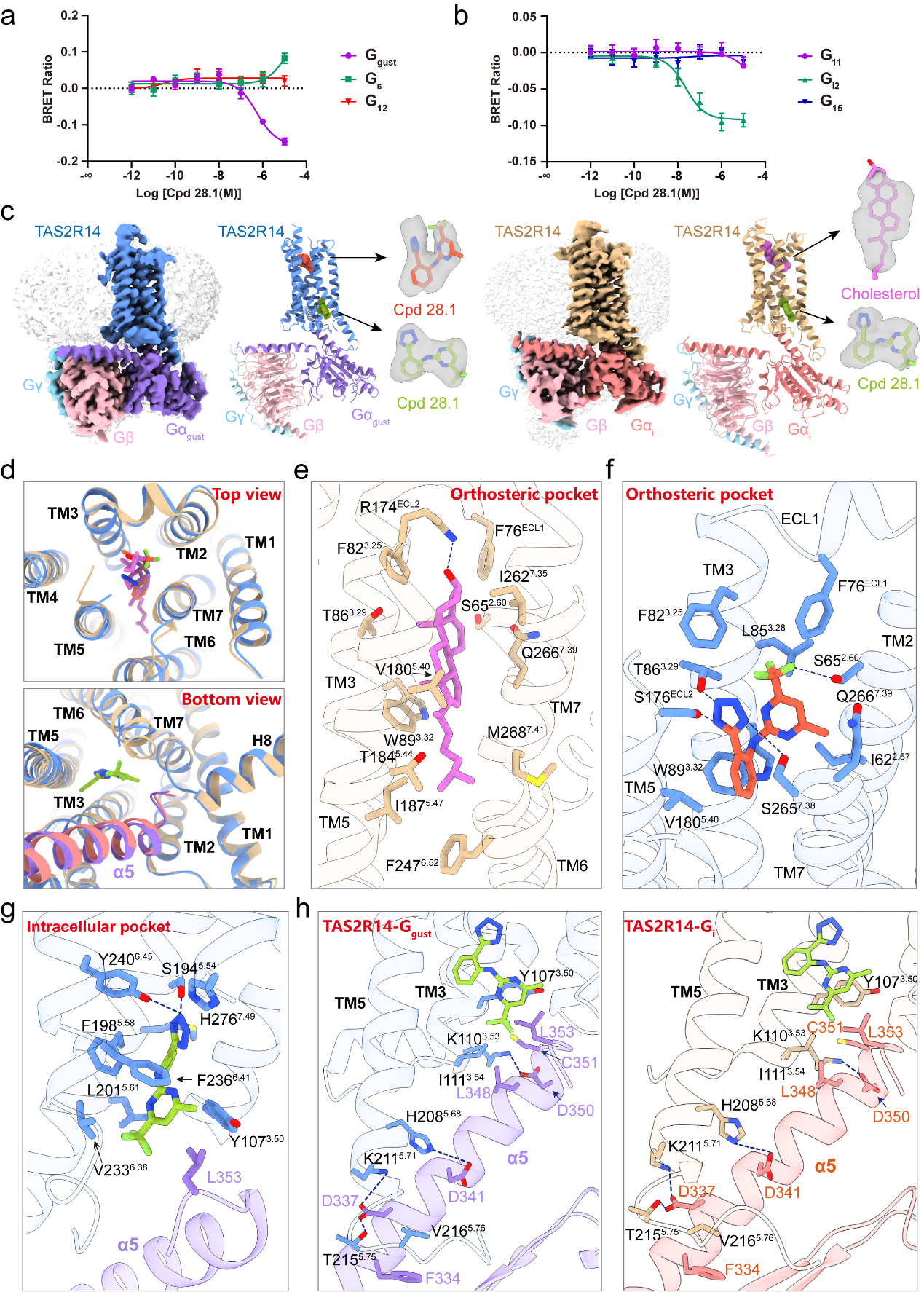
TAS2R14的G蛋白招募活性。图片来源于《细胞研究》
相关论文信息:https://doi.org/10.1038/s41422-024-00995-4
成天软件《人事管理系统 》采用多层软件架构,统一身份认证,数据呈现,能够基于校园网/互联网为高校、医院、研究所人事管理提供先进、实用的信息化管理平台。 已积累百家高校案例,详情电话咨询15851303988。 《高校科研管理系统 》涵盖高校科研管理工作的所有环节,能够适应理工农医类、人文社科类以及综合性高校的管理需求,协助高校建立符合自身特殊需要的人事管理规范,为高校建设数字校园奠定坚实的技术基础与管理基础。
本文转载自:科学网。文章为作者独立观点,不代表成天立场,转载请联系原作者。
点击量:160
湖南师范大学高校人力资源系统
湖南师范大学,作为湖南省内历史悠久、声誉卓著的高等学府,始终将人才培养与师资队伍建设视为学校发展的基石。近年来,学校积极响应国家教育现代化战略,全面升级人力资源管理体系,构建了一套先进、智能的高校人力资源系统,旨在优化教职工管理流程,提升服务质量,激发人才潜力,为学校教育事业的高质量发展提供坚实的人力资源保障。
保山学院高校人力资源系统
保山学院高校人力资源系统,作为学校人事管理的数字化转型引擎,是一个集教职工招聘、人事档案管理、薪酬福利处理、培训与发展、绩效评估、职业规划于一体的综合性平台。该系统旨在优化人力资源管理流程,提升管理效率,强化教职工队伍建设,为保山学院的教育与科研事业发展提供坚实的人力资源保障。
中国科学院之江实验室诚邀优秀青年学者加盟
中国科学院之江实验室诚邀优秀青年学者加盟
中国科学院山西煤炭化学研究所高层次人才招聘公告
中国科学院山西煤炭化学研究所 人事管理,人事管理系统,人事系统,高校人事,人力资源管理,人力资源管理系统,大学人事管理,人事绩效考核
西电杭州研究院高层次人才招聘公告
西电杭州研究院 人事管理系统 招聘公告